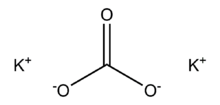
كربونات الپوتاسيوم
كربونات البوتاسيوم إنگليزية: Potassium carbonate: هي ملح أبيض، ذواب في الماء (غير ذواب في الكحول)، والذي يشكل محلول قلوي قوي. تنتج كربونات البوتاسيوم من تفاعل امتصاص هيدروكسيد البوتاسيوم مع ثاني أوكسيد الكربون. وهي مادة متميعة، تظهر عادة كمادة صلبة رطبة. تستخدم كربونات البوتاسيوم في صناعة الصابون والزجاج.[1] Commonly, it can be found as the result of leakage of alkaline batteries.[2]
| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Potassium carbonate
| |
| أسماء أخرى
Potash, pearl ash
| |
| Identifiers | |
| رقم CAS | |
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, ...) |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | K2CO3 |
| كتلة مولية | 138.205 g/mol |
| المظهر | white, hygroscopic solid |
| الكثافة | 2.29 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 112 g/100 mL (20 °C) 156 g/100 mL (100 °C) |
| قابلية الذوبان | insoluble in alcohol, acetone |
| المخاطر | |
| خطر رئيسي | Irritant |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | non-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
1870 mg/kg |
| مركبات ذا علاقة | |
أنيونات أخرى
|
Potassium bicarbonate |
كاتيونات أخرى
|
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.[3]
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
الإنتاج
يحضر كربونات البوتاسيوم تجاريًا بالتحليل الكهربائي لكلوريد البوتاسيوم. هيدروكسيد البوتاسيوم الناتج يتم كربنته باستخدام ثاني أوكسيد الكربون لينتج كربونات البوتاسيوم، والتي تستخدم غالبًا لإنتاج مركبات البوتاسيوم الأخرى:[1]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O ("potash hydrate"). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is used in some types of Chinese noodles and mooncakes, as well as Asian grass jelly and Japanese ramen. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called "Dutching" (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References
- ^ أ ب H. Schultz; G. Bauer; E. Schachl; F. Hagedorn; P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3-527-30673-0.
- ^ List, Jenny (October 19, 2022). "Crusty Leaking Cells Kill Your Tech. Just What's Going On?". Hackaday. Archived from the original on May 30, 2023.
- ^ "Milestones in U.S. patenting". www.uspto.gov (in الإنجليزية الأمريكية). Retrieved 2023-08-04.
- ^ See references to "pearl ash" in "American Cookery" by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars: the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 978-0-252-04108-2.
- ^ Leonard, J.; Lygo, B.; Procter, G. "Advanced Practical Organic Chemistry" 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. "The American Frugal Housewife" 1832
Bibliography
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). "Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol". Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
