إسالة
تسييل أو تمييع إنگليزية: Liquefaction: في الفيزياء، التسييل يعني تحويل شيء ما إلى الحالة السائلة. ويمكن للتمييع أن يتم من الحالة الغازية إلى الحالة السائلة من خلال التكثيف، وعادة بالتبريد، أو التحول من الحالة الصلبة إلى الحالة السائلة من خلال الانصهار، وعادة يتم بالتسخين أو بالطحن والخلط مع سائل آخر لتحفيز الانحلال. ويشير التمييع في الفيزياء والكيمياء ، والهندسة الوراثية إلى عملية تكاثف الغاز إلى سائل, في حين أنه في الجيولوجيا، يشير إلى عملية انهيار أو تصرف الرواسب الطفلية المشبعة بالماء كمائع.
وفي صناعة المحروقات، يشير التسييل إلى إعادة تشكيل الفحم أو الغاز إلى شكل سائل بحيث يسهل نقله واستخدامه كوقود ، وقد قام الألمان خلال الحرب العالمية الثانية بتسييل الفحم عندما تعذر الحصول على البترول لتموين القوات المحاربة بالوقود ، وكان ذلك باهظا الثمن بالمقارنة بتكلفة البترول وتصفيته .
توصف المواد المختلفة وتصنف في إحدى الحالات الرئيسة: غازية أو سائلة أو صلبة، مفترضين ضمناً أن هذا التوصيف هو في درجات الحرارة العادية قرابة 15ْس وتحت الضغط الجوي السائد قرابة الضغط الجوي النظامي 760مم. لكن أية مادة صرفه يمكن أن تنتقل من حالة إلى أخرى عندما تتغير درجة حرارتها أو يتغير الضغط الخاضعة له أو يتغير كلاهما. وتصبح المسألة أكثر تعقيداً إذا كانت المادة مزيجاً من المواد المختلفة. ويظهر هذا التعقيد واضحاً في الحالة الغازية إذ يكون الضغط الكلي مساوياً مجموع الضغوط الجزئية التي يطبقها كل غاز فيما لو شغل الحيز وحده. مثلاً، عندما يكون غاز بخار الماء في الهواء فإن ضغط البخار أقل بكثير من الضغط الجوي الكلي الناتج عن الهواء والبخار، ويتغير هذا الضغط الجزئي بتغير درجة حرارة الجو. وتتأثر دراسة توازن الماء في حالته السائلة مع حالته الغازية بهذا الضغط الجزئي بصورة رئيسة.
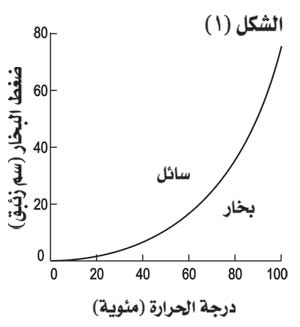
تجري معظم الدراسات الأولى على مواد نقية وفي أوان محدودة الحجم بحيث يمكن تغيير الضغط أو الحجم أو درجة الحرارة. فإذا أخذنا بخار الماء الصرف في إناء بعد تخليته من الهواء، وبدأنا بتبريد الإناء، نرى أن الضغط ينخفض ويستمر في الانخفاض حتى يبدأ البخار بالتكاثف ليصبح جزء منه سائلاً. ويسمى الضغط المقابل عند هذه الحالة ضغط البخار المشبع. وبالمقابل فإن ضغط البخار المشبع الذي يظهر فوق سائله يتعلق بدرجة حرارة السائل ويتغير بتغيرها، فيكون لكل مادة منحن مميز.. يدعى الانتقال، كما ذكر، من الحلة الغازية إلى الحالة السائلة تكاثفاً، أما الانتقال من الحالة السائلة إلى الحالة الغازية فيسمى تبخراً، ويحدث عند الغليان. وتعطى عادة درجات حرارة الغليان تحت الضغط الجوي النظامي، فهي مثلاً 100ْس في حالة الماء.
يستدعي الانتقال من دراسة حالة التوازن بين البخار وسائله في أوان مغلقة إلى دراسة حالة وجود البخار وسائله في أوان مفتوحة إلى الجو، النظر في تأثير كميات الحرارة المتبادلة بين السائل والوسط المحيط. فإذا كانت الآنية مغلقة يمكن أن تسبب كمية الحرارة الداخلة زيادة نسبة كمية البخار (الغاز) إلى كمية السائل، أما إذا كانت الآنية مفتوحة للجو فإنها تسبب ضياعاً للمادة، وخاصة إذا كانت حرارة التبخر صغيرة كما في الهليوم السائل أو الآزوت السائل. لذلك تؤخذ احتياطات خاصة عند نقل هذين السائلين بغية عزل الحاوية عزلاً حرارياً جيداً للإقلال من كمية الحرارة الداخلة إلى السائل عن طريق الإيصال، وكذلك تفضض أو تلمّع للإقلال من كمية الحرارة المتبادلة عن طريق الإشعاع، وكليهما يتأثر بالفرق بين درجتي حرارة الحاوية والوسط الخارجي.ويطلق على مثل هذه الحاويات عادة ديوار Dewer نسبة إلى أول عالم استخدمها للحفاظ على سوائل الغازات لمدة طويلة. وهنا لابد من الإشارة إلى وجوب التمييز بين درجة حرارة السائل مع الوعاء الداخلي الذي يحتويه ودرجة حرارة الوعاء الخارجي الذي يكون عادة في درجة حرارة الجو نفسها. ففي حالة الآزوت السائل مثلاً، تكون درجة حرارته في حاويته قرابة -196ْس. أما في درجة حرارة الغرفة فهو غاز يحتاج إلى ضغوط عالية جداً ليبقى سائلاً، وقد لا تتحمل الأواني مثل هذه الضغوط العالية من أجل سماكات جدران مناسبة، لهذا تستخدم أسطوانات الآزوت العادية التي تنقله في حالته الغازية، ولكن تحت ضغوط عالية، قد تصل إلى عشرات أو مئات الضغط الجوي أحياناً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
في الجيولوجيا
في العلوم الأخرى
تمييع الغازات
تتداخل تأثيرات تغيرات درجة الحرارة والضغط والحجم في كيفية الوصول إلى الحالة السائلة بدءاً من الحالة الغازية، وتعتمد عملية التمييع أو الإسالة على العلاقات بين قيمها المختلفة للمواد المختلفة. أما مسألة الحصول على السوائل من الحالة الصلبة فتهم المختصين في علم المواد، وحديثاً بدأ اهتمام العلماء النوويين فيها بغية استخدام السوائل مبردات في المفاعلات النووية. ولابد من اعتماد دورات حرارية مستمدة من الترموديناميك [ر] إذا ما أريد القيام بعملية التمييع في آلات محدودة الحجم. تتألف هذه الدورات بصورة رئيسة من عدة عمليات توصف عادة بالمتحول أو التابع الذي يبقى ثابتاً في أثناء العملية، فمنها ما يتم تحت درجة حرارة ثابتة، كأن نضغط الغاز وننتظر وقتاً كافياً ليعود إلى درجة الحرارة التي بدأ منها، فيسمى تحولاً متساوي الدرجة، وتعد عملية ضغط الغاز أبسط الآليات المستخدمة في التمييع. وتستخدم آلية ثانية، تلي نزع كمية الحرارة بعد الضغط فنتركه يتمدد، إذ تنخفض درجة حرارة الغاز لدى تمددها عندما يكون معزولاً حرارياً، ويمكن بتكرار ذلك الوصول إلى درجة حرارة التميع لبعض الغازات. وقد تستخدم قطعة مسامية للحفاظ على فرق الضغط بين طرفيها والاستمرار في العملية لتمييع كمية كبيرة من الغاز التبريد.
إن ارتفاع ضغط البخار المشبع مع ارتفاع درجة الحرارة، لا يستمر إلى ضغوط عالية جداً، وإنما ينتهي عند نقطة لا يمكن التمييز عندها بين الغاز والسائل، وبصورة خاصة مسألة إشغال السائل لأسفل الوعاء الذي يحويه، وتسمى هذه النقطة «النقطة الحرجة» وهي تختلف من مادة لأخرى وتحدث من أجل قيم محددة لدرجة الحرارة والضغط تسمى درجة الحرارة الحرجة والضغط الحرج. لذلك لا تعود عملية الضغط ذات فائدة في التمييع ويجب أن تكون قيمة الضغط أقل من قيمة الضغط الحرج. يظهر في الجدول (1) درجة حرارة الغليان النظامية ودرجة الحرارة الحرجة والضغط لبعض الغازات المشهورة: وبما أن درجة حرارة الجو السائدة هي التي تحدد في النهاية مردود المبادلات ومن ثم العمليات، فإننا نرى مدى ارتفاعها مقارنة بدرجة الحرارة الحرجة لبعض الغازات.
درجة حرارة الغليان
درجة الحرارة الحرجة
الضغط الحرج
(سْ)
(سْ)
(ضغط جوي)
الماء
100
374
218.3
الإتير
35
243
63
الأمونيا
-33
132
111.3
الأكسجين
-183
-118
50.1
الآزوت (النتروجين)
-196
-147
33.5
الهدروجين
-250
-240
12.8
الهليوم
-269
-268
2.26
الجدول (1)
التطبيقات
تأتي أهم التطبيقات الصناعية للتمييع في نقل غازات الاحتراق مثل الغاز الطبيعي درجة حرارة غليانه (-162ْس) والبروبان والبوتان، إذ يمكن الحصول على توفير في الحجم يعادل جزء من 600 جزء من حجم الغاز في الشروط النظامية ومن ثم إنقاص التكلفة.
ثم يأتي استعمال سوائل الآزوت والهواء والهليوم في التبريد وفي التبريد المفرط[ في المستشفيات لتشغيل الأجهزة الدقيقة كأجهزة التصوير بالتجاوب المغنطيسي (المرنان) والمجهر الإلكتروني ولتوليد حقول مغنطيسية عالية باستعمال نواقل فائقة وأجهزة أخرى مماثلة. كما يستعمل الآزوت السائل لحفظ الشرائح النسيجية والنطاف في البيطرة والزراعة أو لإجراء عمليات جراحية خاصة.
وقد لا يخلو مختبر أبحاث من تجهيزات تستخدم الآزوت السائل والهليوم السائل للاستفادة من العمل الجيد لبعض القطع الإلكترونية في درجات حرارة منخفضة، فهناك مثلاً أجهزة التقاط الإشارات الضعيفة جداً من الفضاء في النظارات الفلكية وأجهزة الكشف المستعملة فيها (الكاميرا).
ويستعمل التمييع أحياناً كطريقة فصل كيميائية بين مواد مختلفة، مثل الفصل بين الأكسجين الموجود في الهواء والآزوت، بغية الحصول على مواد ذات نقاوة عالية من كل منهما.
المصادر
فوزي عوض. الموسوعة العربية [http://www.arab-ency.com/index.php?module=pnEncyclopedia&func=display_term&id=159917&vid=40
التميع http://www.arab-ency.com/index.php?module=pnEncyclopedia&func=display_term&id=159917&vid=40 التميع]. {{cite web}}: Check |url= value (help); Missing or empty |title= (help); line feed character in |url= at position 92 (help)